G.Patton
Expert
- Joined
- Jul 5, 2021
- Messages
- 2,992
- Solutions
- 3
- Reaction score
- 3,384
- Points
- 113
- Deals
- 1
Introdução.
Cerca de 80% das reacções em laboratório orgânico envolvem um passo chamado refluxo. Utiliza-se um solvente de reação para manter os materiais dissolvidos e a uma temperatura constante, fervendo o solvente, condensando-o e devolvendo-o ao balão. O método do refluxo é também muito utilizado na síntese de drogas como a anfetamina e a metanfetamina e outras feniletilaminas, o LSD, alguns canabinóides sintéticos, a isomerização do CBD, o MDMA e muitos outros casos. Esta técnica é bastante simples, mas não se deve subestimar o seu perigo e tomar todas as precauções.
Visão geral do refluxo.
Uma instalação de refluxo (Fig. 1) permite que o líquido ferva e se condense, com o líquido condensado a regressar ao frasco original. Uma configuração de refluxo é análoga a uma destilação, com a principal diferença sendo a colocação vertical do condensador. O líquido permanece no ponto de ebulição do solvente (ou solução) durante o refluxo ativo.
Um aparelho de refluxo permite o aquecimento fácil de uma solução, mas sem a perda de solvente que resultaria do aquecimento num recipiente aberto. Numa instalação de refluxo, os vapores de solvente são retidos pelo condensador e a concentração dos reagentes permanece constante durante todo o processo. O principal objetivo do refluxo de uma solução é aquecê-la de forma controlada a uma temperatura constante. Por exemplo, imagine que você deseja aquecer uma solução a 60 ℃ por uma hora para conduzir uma reação química. Seria difícil manter um banho de água quente a 60 ℃ sem equipamento especial, e isso exigiria monitoramento regular. No entanto, se o metanol fosse o solvente, a solução poderia ser aquecida até o refluxo, e manteria sua temperatura sem manutenção regular no ponto de ebulição do metanol (65 ℃). É verdade que 65 ℃ não é 60 ℃ e se a temperatura específica fosse crucial para a reação, então seria necessário equipamento de aquecimento especializado. Mas muitas vezes o ponto de ebulição do solvente é escolhido como a temperatura da reação por causa de sua praticidade.
Procedimentos passo a passo.
1. Verter a solução a refluxar para um balão de fundo redondo e fixá-lo ao suporte de anéis ou à treliça com uma pinça de extensão e uma pequena junta de borracha (Fig.2 a e vídeo). O balão não deve estar cheio mais de metade. Por razões desconhecidas, não há juntas de borracha nas figuras. Se estiver a utilizar ebulição a alta temperatura (>150℃) ou aquecimento por chama, não podem ser utilizadas.
2. Adicione uma barra de agitação ou algumas pedras de ebulição para prevenção de solavancos. As pedras de ebulição não devem ser usadas ao refluxar soluções concentradas de ácido sulfúrico ou fosfórico, pois elas colorem a solução. Por exemplo, quando se utiliza uma barra de agitação para evitar choques com ácido sulfúrico concentrado, a solução permanece incolor (Fig.2 b). Quando a mesma reação é conduzida utilizando uma pedra de ebulição, a solução escurece durante o aquecimento (Fig.2 c) e acaba por tornar toda a solução numa cor castanho-púrpura profunda (Fig.2 d).
2. Adicione uma barra de agitação ou algumas pedras de ebulição para prevenção de solavancos. As pedras de ebulição não devem ser usadas ao refluxar soluções concentradas de ácido sulfúrico ou fosfórico, pois elas colorem a solução. Por exemplo, quando se utiliza uma barra de agitação para evitar choques com ácido sulfúrico concentrado, a solução permanece incolor (Fig.2 b). Quando a mesma reação é conduzida utilizando uma pedra de ebulição, a solução escurece durante o aquecimento (Fig.2 c) e acaba por tornar toda a solução numa cor castanho-púrpura profunda (Fig.2 d).
3. Coloca as mangueiras de borracha num condensador (molha primeiro as extremidades para que deslizem) e depois fixa o condensador verticalmente ao balão de fundo redondo. Se utilizar um condensador alto, fixar o condensador ao suporte em anel ou à treliça (Fig.3 a). Certificar-se de que o condensador se encaixa corretamente no balão. Nota de segurança: se as peças não estiverem corretamente ligadas e se houver fuga de vapores inflamáveis, estes podem ser inflamados pela fonte de calor. Não ligar o balão de fundo redondo e o condensador com um clipe de plástico, como mostra a Fig.3 с. Os clipes de plástico podem por vezes falhar (especialmente quando são aquecidos), e esta configuração não permite que o balão seja removido de forma fiável da fonte de calor no final do refluxo.
Nota: Quanto mais elevado for o ponto de ebulição do solvente (mistura de solventes), mais curto será o condensador de refluxo. Pelo contrário, se o solvente ferve a baixas temperaturas (éter), utilize o condensador de refluxo de Liebig mais longo.
4. Ligue a mangueira do braço inferior do condensador à torneira da água e deixe a mangueira do braço superior escorrer para o lava-loiça (Fig.3 b). É importante que a água entre na parte inferior do condensador e saia pela parte superior (para que a água flua contra a gravidade), caso contrário o condensador será ineficaz, pois não encherá completamente.
Nota: Quanto mais elevado for o ponto de ebulição do solvente (mistura de solventes), mais curto será o condensador de refluxo. Pelo contrário, se o solvente ferve a baixas temperaturas (éter), utilize o condensador de refluxo de Liebig mais longo.
4. Ligue a mangueira do braço inferior do condensador à torneira da água e deixe a mangueira do braço superior escorrer para o lava-loiça (Fig.3 b). É importante que a água entre na parte inferior do condensador e saia pela parte superior (para que a água flua contra a gravidade), caso contrário o condensador será ineficaz, pois não encherá completamente.
5. Se várias soluções forem refluxadas ao mesmo tempo (por exemplo, se muitos alunos estiverem a efetuar um refluxo lado a lado), as mangueiras de cada configuração de refluxo podem ser ligadas em série (Fig. 4). Para tal, o braço superior da "Instalação A", que normalmente drena para o lava-loiça, é ligado ao braço inferior da "Instalação B". A ligação de aparelhos em série minimiza a utilização de água, uma vez que a água que sai de um condensador entra no seguinte. Várias configurações de refluxo podem ser ligadas em série, e o fluxo de água deve ser monitorizado para garantir que todas as configurações são adequadamente arrefecidas.
6. Comece a fazer circular um fluxo constante de água através das mangueiras (não tão forte que a mangueira se desloque devido à elevada pressão da água). Verifique novamente se as peças de vidro estão bem encaixadas e, em seguida, posicione a fonte de calor sob o balão. Ligue a placa de agitação se estiver a utilizar uma barra de agitação.
a) Se utilizar uma manta de aquecimento, segure-a no lugar com uma plataforma ajustável (por exemplo, uma rede metálica / braçadeira de anel). Deixe alguns centímetros abaixo da manta para que, quando a reação estiver completa, a manta possa ser baixada e o frasco arrefecido. Se a manta de aquecimento não se adaptar perfeitamente ao tamanho do balão de fundo redondo, rodear o balão com areia para criar um melhor contacto (Fig.5 a).
b) Se se utilizar um banho de areia, enterrar o balão na areia de modo a que a altura da areia seja pelo menos igual ao nível do líquido no balão (Fig.5 b).
c) Se a instalação for deixada sem vigilância durante um longo período de tempo (por exemplo, durante a noite), aperte o fio de cobre sobre as ligações da mangueira ao condensador para evitar que as alterações da pressão da água as façam saltar.
7. Se a fonte de calor foi pré-aquecida (opcional), a solução deve começar a ferver dentro de cinco minutos. Se isso não acontecer, aumente a velocidade de aquecimento. A velocidade de aquecimento adequada ocorre quando a solução está a ferver vigorosamente e se observa um "anel de refluxo" a cerca de um terço da altura do condensador. Um "anel de refluxo" é o limite superior de onde os vapores quentes estão a condensar ativamente. Com algumas soluções (por exemplo, solução aquosa), o anel de refluxo é óbvio com gotículas facilmente visíveis no condensador (Fig.6 a+b). Com outras soluções (por exemplo, muitos solventes orgânicos), o anel de refluxo é mais subtil, mas pode ser visto com uma observação atenta (Fig. 6 c). Pode observar-se um movimento subtil no condensador à medida que o líquido escorre pelos lados do condensador, ou os objectos de fundo podem aparecer distorcidos devido à refração da luz através do líquido de condensação (na Fig. 6 d, o pólo do suporte do anel está distorcido).
8. Se seguir um procedimento em que deve refluir durante um determinado período de tempo (por exemplo, "refluxo durante uma hora"), o período de tempo deve começar quando a solução não está apenas a ferver, mas a refluir ativamente no terço inferior do condensador.
9. O calor deve ser reduzido se o anel de refluxo subir até meio do condensador ou mais, ou então os vapores podem escapar do balão.
10. Quando o refluxo estiver completo, desligar a fonte de calor e retirar o balão do calor, levantando o aparelho de refluxo ou baixando a fonte de calor (Fig. 7 a).
9. O calor deve ser reduzido se o anel de refluxo subir até meio do condensador ou mais, ou então os vapores podem escapar do balão.
10. Quando o refluxo estiver completo, desligar a fonte de calor e retirar o balão do calor, levantando o aparelho de refluxo ou baixando a fonte de calor (Fig. 7 a).
Não desligue a água que flui através do condensador até que a solução esteja apenas quente ao toque. Após alguns minutos de arrefecimento ao ar, o balão de fundo redondo pode ser imerso num banho de água da torneira para acelerar o processo de arrefecimento (Fig.7 b).
Refluxo seco.
Se tiver de manter o vapor de água atmosférico fora da sua reação, deve utilizar um tubo de secagem e o adaptador de entrada na configuração do refluxo (Fig. 8). Pode utilizá-los se precisar de manter o vapor de água fora de qualquer sistema, não apenas da configuração de refluxo.
agem
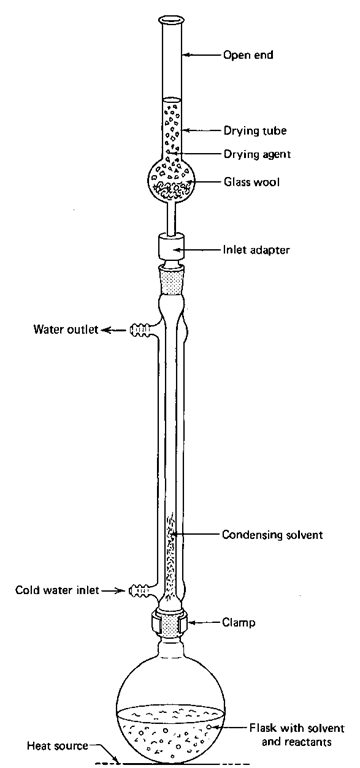
1. Se necessário, limpe e seque o tubo de secagem. Não é necessário efetuar uma limpeza completa, a não ser que suspeite que o agente de secagem anidro já não o é. Se o material estiver endurecido no interior do tubo, é provável que esteja morto. Deve-se limpar e recarregar o tubo no início do procedimento. Certifique-se de que utiliza cloreto ou sulfato de cálcio anidro. Deve ficar bom em poucas utilizações. Se tiver sorte, o Drierite indicativo, um sulfato de cálcio anidro especialmente preparado, pode ser misturado com o Drierite branco. Se a cor for azul, o secante é bom; se for vermelho, o secante já não está seco e deve ser eliminado (ver Dessecantes em "Dessecadores de vácuo").
2. Coloque um tampão solto de lã de vidro ou algodão para evitar que o agente de secagem caia no balão de reação.
3. Montar o aparelho como se indica, com o tubo de secagem e o adaptador em cima do condensador.
4. Nesta altura, os reagentes podem ser adicionados ao balão e aquecidos com o aparelho. Normalmente, o aparelho é aquecido enquanto está vazio para expulsar a água das paredes do aparelho.
5. Aquecer o aparelho, normalmente vazio, num banho de vapor, dando de vez em quando um quarto de volta a todo o conjunto para o aquecer uniformemente. Pode ser utilizado um queimador se não houver perigo de incêndio e se o aquecimento for efectuado com cuidado. As juntas pesadas de vidro esmerilado racham se forem demasiado aquecidas.
6. Deixar o aparelho arrefecer até à temperatura ambiente. À medida que o aparelho arrefece, o ar é aspirado através do tubo de secagem antes de atingir o aparelho. A humidade do ar é retida pelo agente de secagem.
7. Adicione rapidamente os reagentes ou solventes secos ao balão de reação e volte a montar o sistema.
8. Efetuar a reação como habitualmente, como um refluxo normal.
2. Coloque um tampão solto de lã de vidro ou algodão para evitar que o agente de secagem caia no balão de reação.
3. Montar o aparelho como se indica, com o tubo de secagem e o adaptador em cima do condensador.
4. Nesta altura, os reagentes podem ser adicionados ao balão e aquecidos com o aparelho. Normalmente, o aparelho é aquecido enquanto está vazio para expulsar a água das paredes do aparelho.
5. Aquecer o aparelho, normalmente vazio, num banho de vapor, dando de vez em quando um quarto de volta a todo o conjunto para o aquecer uniformemente. Pode ser utilizado um queimador se não houver perigo de incêndio e se o aquecimento for efectuado com cuidado. As juntas pesadas de vidro esmerilado racham se forem demasiado aquecidas.
6. Deixar o aparelho arrefecer até à temperatura ambiente. À medida que o aparelho arrefece, o ar é aspirado através do tubo de secagem antes de atingir o aparelho. A humidade do ar é retida pelo agente de secagem.
7. Adicione rapidamente os reagentes ou solventes secos ao balão de reação e volte a montar o sistema.
8. Efetuar a reação como habitualmente, como um refluxo normal.
Adição e refluxo.
De vez em quando, é necessário adicionar um composto a uma preparação enquanto a reação decorre, normalmente juntamente com um refluxo. Bem, não se abre o sistema, deixando sair fumos tóxicos e ficando doente para adicionar novos reagentes. Utiliza-se um funil de adição. Falámos de funis de adição com funis de separação (material de vidro de laboratório) quando estávamos a considerar a haste, e isso pode ter sido confuso.
Utilização do funil.
Observe a Fig.9 a. Trata-se de um verdadeiro funil de separação. Colocam-se aqui líquidos, agitam-se e extraem-se. Mas será que se pode usar este funil para adicionar material a uma preparação? Não. Não tem junta de vidro esmerilado na extremidade; e só as juntas de vidro encaixam nas juntas de vidro. A Fig.9 c mostra um funil de adição com equalização de pressão. Lembra-se de quando o avisavam para retirar a rolha de um funil de separação, para não criar vácuo no interior do funil quando o esvaziava? De qualquer forma, a arma lateral iguala a pressão em ambos os lados do líquido que está a adicionar ao balão, para que este flua livremente, sem formação de vácuo e sem ter de retirar a rolha. Este equipamento é muito bonito, muito caro, muito limitado e muito raro. E se tentarmos uma extração num destes, todo o líquido escorrerá do tubo para o chão quando agitarmos o funil. Por isso, chegou-se a um compromisso (Fig.9 b). Uma vez que provavelmente fará mais extracções do que adições, com ou sem refluxo, o tubo de equalização da pressão foi retirado, mas a junta de vidro esmerilado manteve-se. Extracções; sem problemas. A natureza da haste não é importante. Mas durante as adições, terá de assumir a responsabilidade de garantir que não ocorre uma desagradável acumulação de vácuo. Pode retirar a rolha de vez em quando ou colocar um tubo de secagem e um adaptador de entrada no lugar da rolha. Este último mantém a humidade fora e evita a acumulação de vácuo no interior do funil.
Como preparar
Existem pelo menos duas formas de preparar uma adição e refluxo, utilizando um balão de três gargalos ou um adaptador de Claisen. Pensei em mostrar estas duas configurações com tubos de secagem. Estes impedem que a humidade do ar entre na reação. Se não precisares deles, não os uses.
Utilização do funil.
Observe a Fig.9 a. Trata-se de um verdadeiro funil de separação. Colocam-se aqui líquidos, agitam-se e extraem-se. Mas será que se pode usar este funil para adicionar material a uma preparação? Não. Não tem junta de vidro esmerilado na extremidade; e só as juntas de vidro encaixam nas juntas de vidro. A Fig.9 c mostra um funil de adição com equalização de pressão. Lembra-se de quando o avisavam para retirar a rolha de um funil de separação, para não criar vácuo no interior do funil quando o esvaziava? De qualquer forma, a arma lateral iguala a pressão em ambos os lados do líquido que está a adicionar ao balão, para que este flua livremente, sem formação de vácuo e sem ter de retirar a rolha. Este equipamento é muito bonito, muito caro, muito limitado e muito raro. E se tentarmos uma extração num destes, todo o líquido escorrerá do tubo para o chão quando agitarmos o funil. Por isso, chegou-se a um compromisso (Fig.9 b). Uma vez que provavelmente fará mais extracções do que adições, com ou sem refluxo, o tubo de equalização da pressão foi retirado, mas a junta de vidro esmerilado manteve-se. Extracções; sem problemas. A natureza da haste não é importante. Mas durante as adições, terá de assumir a responsabilidade de garantir que não ocorre uma desagradável acumulação de vácuo. Pode retirar a rolha de vez em quando ou colocar um tubo de secagem e um adaptador de entrada no lugar da rolha. Este último mantém a humidade fora e evita a acumulação de vácuo no interior do funil.
Como preparar
Existem pelo menos duas formas de preparar uma adição e refluxo, utilizando um balão de três gargalos ou um adaptador de Claisen. Pensei em mostrar estas duas configurações com tubos de secagem. Estes impedem que a humidade do ar entre na reação. Se não precisares deles, não os uses.
Pedras de ebulição (lascas de ebulição).
As pedras de ebulição (ou chips de ebulição) são pequenos pedaços de rocha negra porosa (frequentemente carboneto de silício) que são adicionados a um solvente ou solução. Contêm ar aprisionado que borbulha quando o líquido é aquecido e têm uma área de superfície elevada que pode atuar como locais de nucleação para a formação de bolhas de solvente. Devem ser adicionados a um líquido frio, não a um que esteja perto do seu ponto de ebulição, ou pode ocorrer uma erupção vigorosa de bolhas. Quando um líquido é levado à ebulição usando pedras de ebulição, as bolhas tendem a originar-se principalmente das pedras (Fig.11 b). As pedras de ebulição não podem ser reutilizadas, pois após uma utilização, as suas fendas enchem-se de solvente e deixam de poder criar bolhas.
As pedras de ebulição não devem ser utilizadas para aquecer soluções concentradas de ácido sulfúrico ou fosfórico, pois podem degradar e contaminar a solução. Por exemplo, a Fig.12 mostra uma reação de esterificação de Fischer que utiliza ácido sulfúrico concentrado. Quando se utiliza uma barra de agitação para evitar choques, a solução permanece incolor (Fig.12 a). Quando a mesma reação é conduzida utilizando uma pedra de ebulição, a solução escurece durante o aquecimento (Fig.12 b) e acaba por tornar toda a solução numa cor castanho-púrpura profunda (Fig.12 c). Para além de contaminar a solução, a cor escura dificulta a manipulação do material com um funil de separação: duas camadas estão presentes na Fig.12 d, embora seja muito difícil de ver.
.12

a) Reação de esterificação de Fischer usando uma barra de agitação (a solução é incolor), b) A mesma reação usando pedras a ferver, c) A mesma reação após alguns minutos de aquecimento, d) Duas camadas escuras no funil de separação como resultado da solução escurecidaMétodos de aquecimento e inflamabilidade.
- Em alguns contextos, a escolha da fonte de calor a utilizar é crítica, enquanto noutros contextos várias podem funcionar igualmente bem. A escolha da fonte de calor a utilizar depende de vários factores.
- Disponibilidade (a sua instituição possui o equipamento?)
- Taxa de aquecimento (pretende aquecer gradual ou rapidamente?)
- Flexibilidade do aquecimento (o calor precisa de ser movimentado à volta de um aparelho?)
- Temperatura final necessária (os líquidos com baixo ponto de ebulição exigem uma abordagem diferente dos líquidos com alto ponto de ebulição)
- Inflamabilidade do conteúdo
Como a segurança é um fator importante nas escolhas laboratoriais, é importante considerar a inflamabilidade do líquido a ser aquecido. Quase todos os líquidos orgânicos são considerados "inflamáveis", o que significa que são capazes de pegar fogo e manter a combustão (uma exceção importante é que os solventes halogenados tendem a não ser inflamáveis). No entanto, isto não significa que todos os líquidos orgânicos se incendeiem imediatamente se forem colocados perto de uma fonte de calor. Muitos líquidos necessitam de uma fonte de ignição (uma faísca, fósforo ou chama) para que os seus vapores se incendeiem, uma propriedade frequentemente descrita pelo ponto de inflamação do líquido. O ponto de inflamação é a temperatura a que os vapores podem ser inflamados com uma fonte de ignição. Por exemplo, o ponto de inflamação do etanol a 70% é de 16,6 ℃, o que significa que pode incendiar-se à temperatura ambiente com um fósforo. Um bico de Bunsen é uma excelente fonte de ignição (e pode atingir temperaturas de aproximadamente 1500 ℃), tornando os queimadores um sério risco de incêndio com líquidos orgânicos e uma fonte de calor que deve ser evitada com frequência.
Outra propriedade importante na discussão da inflamabilidade é a temperatura de auto-ignição de um líquido: a temperatura em que a substância se inflama espontaneamente sob pressão normal e sem a presença de uma fonte de ignição. Esta propriedade é particularmente útil porque não requer uma chama (que é frequentemente evitada no laboratório orgânico), mas apenas uma área quente. Uma superfície de uma placa de aquecimento colocada em "alta" pode atingir temperaturas de até 350 ℃. Nota de segurança: como o éter dietílico, o pentano, o hexano e o éter de petróleo de baixo ponto de ebulição têm temperaturas de auto-ignição inferiores a este valor (Fig.14), seria perigoso ferver estes solventes numa placa de aquecimento, uma vez que os vapores poderiam sair do recipiente e incendiar-se em contacto com a superfície da placa de aquecimento. Em geral, deve ter-se cuidado ao utilizar uma placa de aquecimento para aquecer qualquer líquido volátil e inflamável num recipiente aberto, uma vez que é possível que os vapores ultrapassem o revestimento cerâmico da placa de aquecimento e entrem em contacto com o elemento de aquecimento por baixo, que pode estar mais quente do que 350oC. É por esta razão que as placas de aquecimento não são a melhor escolha para aquecer recipientes abertos com líquidos orgânicos voláteis, embora em alguns casos possam ser utilizadas com precaução quando reguladas para "baixo" e utilizadas numa hotte bem ventilada.
Outra propriedade importante na discussão da inflamabilidade é a temperatura de auto-ignição de um líquido: a temperatura em que a substância se inflama espontaneamente sob pressão normal e sem a presença de uma fonte de ignição. Esta propriedade é particularmente útil porque não requer uma chama (que é frequentemente evitada no laboratório orgânico), mas apenas uma área quente. Uma superfície de uma placa de aquecimento colocada em "alta" pode atingir temperaturas de até 350 ℃. Nota de segurança: como o éter dietílico, o pentano, o hexano e o éter de petróleo de baixo ponto de ebulição têm temperaturas de auto-ignição inferiores a este valor (Fig.14), seria perigoso ferver estes solventes numa placa de aquecimento, uma vez que os vapores poderiam sair do recipiente e incendiar-se em contacto com a superfície da placa de aquecimento. Em geral, deve ter-se cuidado ao utilizar uma placa de aquecimento para aquecer qualquer líquido volátil e inflamável num recipiente aberto, uma vez que é possível que os vapores ultrapassem o revestimento cerâmico da placa de aquecimento e entrem em contacto com o elemento de aquecimento por baixo, que pode estar mais quente do que 350oC. É por esta razão que as placas de aquecimento não são a melhor escolha para aquecer recipientes abertos com líquidos orgânicos voláteis, embora em alguns casos possam ser utilizadas com precaução quando reguladas para "baixo" e utilizadas numa hotte bem ventilada.
Como a combustão é uma reação na fase de vapor, os líquidos com pontos de ebulição baixos (< 40 ℃) tendem a ter pontos de inflamação e temperaturas de auto-ignição baixos, uma vez que têm pressões de vapor significativas (Fig.12). Todos os líquidos com baixo ponto de ebulição devem ser tratados com mais cuidado do que os líquidos com pontos de ebulição moderados (> 60 ℃).
Last edited by a moderator:


