G.Patton
Expert
- Joined
- Jul 5, 2021
- Messages
- 2,966
- Solutions
- 3
- Reaction score
- 3,343
- Points
- 113
- Deals
- 1
Inleiding
Lyserginezuur, het basisfragment afgeleid van de moederkorenalkaloïden, is gesynthetiseerd in veertien stappen, beginnend met 3-bèta-carboxyethylindool. Het uitgangsmateriaal werd omgezet in het tussenproduct 1-benzoyl-5-keto-1,2,2a-3,4,5-hexahydrobenz-[cd]-indool (3), dat drie van de vier ringen bevat die aanwezig zijn in lyserginezuur. Dit keton werd op zijn beurt omgezet in de tetracyclische verbinding 9-keto-7-methyl-4,5,5a,6,6a,7,8,9-octahydroindolo-[4.3-fe]-quinoline (8) en vervolgens in lyserginezuur (14). Deze synthese is niet eenvoudig en vereist veel laboratoriumervaring en scheikundige kennis. Bovendien zijn er verschillende manipulaties met gevaarlijke stoffen, die met strikte veiligheidsmaatregelen moeten worden uitgevoerd.
Kookpunt: 536,2±50,0 °C bij 760 mm Hg;
Smeltpunt: 240 °C;
Molecuulgewicht: 268,31 g/mol;
Dichtheid: 1,4 ± 0,1 g/mL;
CAS-nummer: 82-58-6.
Apparatuur en glaswerk:
- Stalen hydrogeneringsreactor 2-3 L;
- Stalen autoclaaf 500 mL;
- Laboratoriumweegschaal (0,01 - 500 g is geschikt);
- Rondbodemkolven van 100, 200, 500 mL, 5 en 10 L;
- Waterstof (H2) compressor en oorsprong;
- Buchner kolf en trechter (groot) 5 L [Schott filter kan gebruikt worden voor kleine hoeveelheden];
- Rotovapmachine (groot);
- Vacuümbron;
- Scheitrechters 500 mL en 2 L;
- Stikstofballon ~50-70 L (1 bar);
- Zeefdoppen voor kolven;
- Zout ijsbad;
- 5 L x2, 2 L x2; 1 L x2; 500 mL x2; 100 mL x3; 50 mL x2 Bekerglazen;
- Glazen injectiespuit of pasteurpipet;
- Magneetroerder of bovenroerder;
- Vacuümdestillatieopstelling;
- Terugvloeikoeler;
- Retortstandaard en klem om apparatuur vast te zetten;
- Laboratoriumthermometer (-20 °C tot 200 °C) met kolfadapter;
- pH-indicatorpapier;
- Glazen staaf en spatel;
- 250 watt gloeilamp.
Reagentia.
- 3-Indolepropionzuur (1), 94,6 g (0,5 mol);
- 9,5 L gedestilleerd water (H2O);
- ~400 g natriumhydroxide (NaOH);
- 116 g Raney nikkel (Ni);
- 1050 mL geconcentreerd zoutzuur (HCl);
- 2 mL Zwavelzuur (H2SO4 conc.);
- 210 mL 12N natriumhydroxide (NaOH) aq. oplossing;
- 180 ml benzoylchloride;
- ~1.5 L Methanol (MeOH);
- ~1.6 L Ethanol (EtOH);
- 201,2 mL Thionylchloride (SOCl2);
- 1950 mL Koolstofdisulfide (CS2);
- 240 g Aluminiumchloride (AlCl3);
- 2,5 L Benzeen;
- 500 mL 2N natriumhydroxide (NaOH);
- ~3.2 L Diethylether (Et2O);
- 3,3 L ijsazijn (AcOH);
- 352 g (1,1 mol) Pyridine hydrobromide perbromide;
- 5 L chloroform (CHCl3);
- ~1000 g Magnesiumsulfaat (MgSO4);
- 307 g (2,35 mol) Methylaminoaceton ethyleenketaal (5);
- 4,5 L Benzeen;
- ~500 g Geactiveerde koolstof (C);
- ~1 L Aceton;
- ~500 g Natriumbicarbonaat (NaHCO3);
- 80 mL Koud azijnzuuranhydride (Ac2O);
- 1,5 g Natriumboorhydride (NaBH4);
- 75 mL Zwaveldioxide (SO2 vloeibaar);
- 40 g Natriumcyanide (NaCN poeder);
- 300 mL Waterstofcyanide (HCN vloeibaar);
- 78 mL 1,5% kaliumhydroxide (KOH), oplossing aq;
- 8,5 g gehydrateerd natriumarsenaat;
- ~ 50 mL Xyleen;
- 100 mL Verdunde ammoniumhydroxide (NH4OH) oplossing;
- 16,9 g natriummethoxide (MeONa).
Procedure
1-Benzoyl-3-(beta-carboxyethyl)-2,3-dihydroindool (2)3-Indolepropionzuur (1), 94,6 g (0,5 mol), werd opgelost in 600 mL water met 20 g natriumhydroxide. De oplossing werd gemengd met ongeveer 100 g Raney nikkel katalysator en gehydrogeneerd bij RT in een 2-3 L stalen hydrogenatie bom bij 3000-4000 psi (207-276 bar) H2 druk. De reductie was gewoonlijk in 20-30 uur voltooid, waarna de katalysator werd gefilterd en met een beetje water werd gewassen. Geconcentreerd HCl-zuur, 85 ml, werd toegevoegd aan het filtraat en de oplossing werd afgekoeld. Als de reductie onvolledig was, scheidde zich op dit punt niet-gereageerd indoolpropionzuur af dat door filtratie werd verwijderd. Het filtraat werd vervolgens benzoëlast volgens de gebruikelijke Schotten-Baumann procedure met 210 ml 12N natriumhydroxide en 180 ml benzoylchloride. De oplossing werd tijdens de benzoylering alkalisch gehouden en de temperatuur werd door koeling onder 40 °C gehouden. Toen het benzoylchloride volledig gereageerd was, werd het mengsel afgekoeld en aangezuurd met 300 ml geconcentreerd HCl-zuur. Het ruwe product werd gefilterd en gewassen met water, waarna het werd geëxtraheerd met 4 x 1 L porties heet water om het benzoëzuur te verwijderen. Het hete stroperige product (2) werd na decanteren van het waterige extract gekristalliseerd uit een paar volumes methanol; opbrengst 103 g (70 %), MP: 151-153 °C.
1-Benzoyl-5-keto-1,2,2a,3,4,5-hexahydrobenz-[cd]-indool (3)
1-Benzoyl-3-(beta-carboxyethyl)-2,3-dihydroindool (2), 118 g (0,4 mol), werd gemengd met 200 mL zuiver thionylchloride. De oplossing liet men 30 min staan, waarna men het gedurende 15-20 min zachtjes verwarmde op het stoombad. Overtollig thionylchloride werd volledig verdampt onder 30 °C in vacuo, en het ruwe zuurchloride werd opgelost in 200 mL koolstofdisulfide. De oplossing van het zuurchloride werd vervolgens in een dunne stroom toegevoegd aan een krachtig geroerde suspensie van 240 g aluminiumchloride in 1750 mL koolstofdisulfide in een 5 L-kolf (in de HOED!!). Een complex scheidde zich af en roeren werd moeilijk. Het mengsel werd onder reflux verwarmd en een uur geroerd om de reactie te voltooien, waarna het zeer voorzichtig werd ontleed door 500 g ijs, 250 mL conc. HCl zuur en 500 mL water toe te voegen. Tijdens de ontleding bleef men roeren en werd de koeling beïnvloed door periodieke destillatie van het koolstofdisulfide in vacuo, waarna het product werd geëxtraheerd met 2 L benzeen. Het extract werd grondig gewassen met 500 mL 2N natriumhydroxide in drie porties en vervolgens met water. Het werd gedroogd boven magnesiumsulfaat en vervolgens in vacuo tot een klein volume ingedampt. Door langzame toevoeging van verschillende volumes ether kristalliseerde het gele keton (3) . Het werd gefiltreerd en gewassen met ether; opbrengst 85,3 g (77%), MP: 146-147 °C. Een monster werd geherkristalliseerd voor analyse uit benzeen-ether.
1-Benzoyl-3-(beta-carboxyethyl)-2,3-dihydroindool (2), 118 g (0,4 mol), werd gemengd met 200 mL zuiver thionylchloride. De oplossing liet men 30 min staan, waarna men het gedurende 15-20 min zachtjes verwarmde op het stoombad. Overtollig thionylchloride werd volledig verdampt onder 30 °C in vacuo, en het ruwe zuurchloride werd opgelost in 200 mL koolstofdisulfide. De oplossing van het zuurchloride werd vervolgens in een dunne stroom toegevoegd aan een krachtig geroerde suspensie van 240 g aluminiumchloride in 1750 mL koolstofdisulfide in een 5 L-kolf (in de HOED!!). Een complex scheidde zich af en roeren werd moeilijk. Het mengsel werd onder reflux verwarmd en een uur geroerd om de reactie te voltooien, waarna het zeer voorzichtig werd ontleed door 500 g ijs, 250 mL conc. HCl zuur en 500 mL water toe te voegen. Tijdens de ontleding bleef men roeren en werd de koeling beïnvloed door periodieke destillatie van het koolstofdisulfide in vacuo, waarna het product werd geëxtraheerd met 2 L benzeen. Het extract werd grondig gewassen met 500 mL 2N natriumhydroxide in drie porties en vervolgens met water. Het werd gedroogd boven magnesiumsulfaat en vervolgens in vacuo tot een klein volume ingedampt. Door langzame toevoeging van verschillende volumes ether kristalliseerde het gele keton (3) . Het werd gefiltreerd en gewassen met ether; opbrengst 85,3 g (77%), MP: 146-147 °C. Een monster werd geherkristalliseerd voor analyse uit benzeen-ether.
1-Benzoyl-4-bromo-5-keto-1,2,2a,3,4,5-hexahydrobenz-[cd]-indole (4)
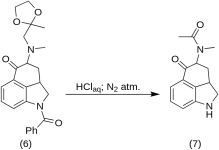
1-Benzoyl-2,2a,3,4-tetrahydro-4-[methyl-(2-methyl-1,2-dioxolaan-2-yl-methyl)-amino]-benz-[cd]-indol-5-(1H)-one (6)
Een oplossing van 270 g (0,76 mol) 1-benzoyl-4-broom-5-keto-1,2,2a,3,4,5-hexahydrobenz-[cd]-indool(4) en 307 g (2,35 mol) methylaminoxymethyl-2,2-dioxolaan-2-yl-methyl)-amino]-benz-[cd]-indol-5-(1H)-one (6).35 mol) methylaminoacetonethyleenketaal (5) in 4500 mL droog benzeen werd 21 uur onder stikstof teruggeblazen in 10 L RBF met terugvloeikoeler. Het mengsel werd afgekoeld en 151 g (93,5 %) methylaminoacetonethyleenketaalhydrobromide werd gefiltreerd, MP: 158-159 °C.
Het filtraat werd verschillende keren gewassen met ijswater, waarna het werd geëxtraheerd met 2,5 L koud, verdund HCl-zuur met 150 ml van het geconcentreerde zuur. De zure extracten werden onmiddellijk toegevoegd aan een overmaat ijskoud verdund natriumhydroxide. Het product werd geëxtraheerd met 1 liter chloroform en de chloroformoplossing werd gedroogd boven magnesiumsulfaat, behandeld met koolstof en geconcentreerd in vacuo. Het overblijvende ketalketon (6) werd gekristalliseerd uit aceton; MP: en mengsel MP: 135-136 °C, opbrengst 220 g (71 %).
5-Keto-4-[N-methyl-N-acetonylamino]-1,2,2a,3,4,5-hexahydrobenz-[cd]-indool (7)
20 g 1-benzoyl-2,2a,3,4-tetrahydro-4-[methyl-(2-methyl-1.,3-dioxolan-2-yl-methyl)-amino]-benz-[cd]-indol-5-(1H)-one (6) werd opgelost in een mengsel van 250 ml geconcentreerd HCl-zuur en 250 ml water, en de oplossing werd vijf dagen onder stikstof bewaard bij 37 °C in 3-5 L RBF. Het mengsel werd afgekoeld, behandeld met koolstof, gefiltreerd en het filtraat werd in vacuo geconcentreerd tot een klein volume. Het residu werd behandeld met een overmaat natriumbicarbonaat; het product werd geëxtraheerd met koude chloroform en het oplosmiddel werd in vacuo bij kamertemperatuur verwijderd. De ruwe diketon (7) werd in poedervorm gebracht, overgoten met ongeveer 75 mL 1:1 benzeen-ether en gefiltreerd; opbrengst 9,8 g (77 %), MP: 105-107 °C. Een monster voor analyse werd geherkristalliseerd uit benzeenether of ethanol; MP: 109-110 °C; een monohydrochloride werd verkregen uit verdunde ethanol; MP: 200 °C dec.
9-Keto-7-methyl-4,5,5a,6,6a,7,8,9-octahydroindolo-[4,3-fg]-quinoline (8)
25 g 5-Keto-4-[N-methyl-N-acetonyl]-amino-1,2,2a,3,4,5-hexahydrobenz-[cd]-indool (7) werd gemengd met 550 mL absolute ethanol. Het mengsel werd geroerd onder stikstof en gekoeld tot -15 °C in 2-5 L RBF. Vervolgens werd natriummethoxide (16,9 g) toegevoegd en werd het mengsel gedurende tien minuten bij -10 °C tot -12 °C geroerd. Het reactiemengsel werd afgekoeld tot -25 °C en het product werd gefiltreerd op een 6,5 inch buchnertrechter en gewassen met een beetje koude ethanol en ether. Met zo min mogelijk blootstelling aan lucht (bevat natriummethoxide!) werd het ruwe keton (8) onmiddellijk overgoten met een beetje ijswater en opnieuw gefiltreerd. Het werd gewassen met ijswater, ethanol en ether; opbrengst 16,2 g (69 %), MP: 145-147 °C. Een analytisch monster werd geherkristalliseerd uit verdunde ethanol; MP: 155-157 °C; het dihydrochloride werd bereid en geherkristalliseerd uit waterige aceton; MP: 270 °C dec.
4-Acetyl-9-keto-7-methyl-4,5,5a,6,6a,7,8,9-octahydroindolo-[4,3-fg]-quinoline (9)
9-Keto-7-methyl-4,5,5a,6,6a,7,8,9-octahydroindolo-[4,3-fg]-quinoline (8), 24 g, werd toegevoegd aan 80 mL koud azijnzuuranhydride. Het mengsel werd ongeveer 5 minuten bij 25 °C gehouden in 200 ml RBF, waarna het grondig werd afgekoeld en het product (9) werd gefiltreerd en met ether gewassen; opbrengst 20,5 g (76 %), mp: 167-170 °C. Een tweede oogst werd verkregen door verdamping van het filtraat; dit bracht de totale opbrengst op 82%. Een monster werd geherkristalliseerd uit aceton-ethanol; MP: 169-170 °C; Het hydrochloride werd bereid in ethanol en werd geherkristalliseerd uit waterige ethanol; MP: 250 °C dec.
9-Keto-7-methyl-4,5,5a,6,6a,7,8,9-octahydroindolo-[4,3-fg]-quinoline (8), 24 g, werd toegevoegd aan 80 mL koud azijnzuuranhydride. Het mengsel werd ongeveer 5 minuten bij 25 °C gehouden in 200 ml RBF, waarna het grondig werd afgekoeld en het product (9) werd gefiltreerd en met ether gewassen; opbrengst 20,5 g (76 %), mp: 167-170 °C. Een tweede oogst werd verkregen door verdamping van het filtraat; dit bracht de totale opbrengst op 82%. Een monster werd geherkristalliseerd uit aceton-ethanol; MP: 169-170 °C; Het hydrochloride werd bereid in ethanol en werd geherkristalliseerd uit waterige ethanol; MP: 250 °C dec.
4-Acetyl-9-hydroxy-7-methyl-4,5,5a,6,6a,7,8,9-octahydroindolo-[4,3-fg]-chinoline (10)
10 g 4-acetyl-9-keto-7-methyl-4,5,5a,6,6a,7,8,9-octahydroxindolo-[4,3-fg]-quinoline (9) werd toegevoegd aan een mengsel van 150 ml methanol en 10 ml water in 500 ml RBF. Natriumborohydride, 1,5 g, werd toegevoegd en de reactie mocht bij RT verdergaan tot een klein volume, waarna een mengsel van 15 mL conc. HCl zuur en 60 mL water werd toegevoegd. Het hydrochloride (10) dat bij afkoeling werd afgescheiden, werd gefiltreerd en gewassen met methanol, 9,0 g (79 %). Een monster werd geherkristalliseerd uit verdunde ethanol; MP: 245-246 °C dec.
4-Acetyl-9-chloor-7-methyl-4,5,5a,6,6a,7,8,9-octahydroindolo-[4,3-fg]-chinolinehydrochloride (11)
4-Acetyl-9-hydroxy-7-methyl-4,5,5a,6,6a,7,8,9-octahydroindolo-[4,3-fg]-chinolinehydrochloride (10), 3,1 g, werd opgelost in 75 ml ( 10).1 g, werd opgelost in 75 mL vloeibaar zwaveldioxide in een glazen voering in een stalen autoclaaf van 500 mL. Thionylchloride (1,2 mL) werd toegevoegd, het vat werd afgesloten en 6 uur bij 25 °C gehouden. De autoclaaf werd ontlucht en het reactiemengsel werd verwijderd. Zwaveldioxide mocht verdampen terwijl het volume van de oplossing constant werd gehouden door de langzame toevoeging van droge ether. Het amorfe chloorhydrochloride (11) werdgefiltreerd, gewassen met ether en gedroogd in vacuo, MP: 130-135 °C dec. Opbrengst 3,5 g. Gebruik van de 9-beta-epimerische alcohol in deze reactie gaf hetzelfde chloride in vergelijkbare opbrengst.
4-Acetyl-9-cyaan-7-methyl-4,5,5a,6,6a,7,8,9-octahydroindolo-[4,3-fg]-chinoline (12)
40 g droog, poedervormig natriumcyanide werd toegevoegd aan 300 ml ijskoud vloeibaar waterstofcyanide. Het mengsel werd geroerd en in ijs afgekoeld, en 7,5 g ruw amorf 4-acetyl-9-chloor-7-methyl-4,5,5a,6,6a,7,8,9-octahydroindolo [4,3f/g]-chinolinehydrochloride (11) werd toegevoegd. Het roeren werd gedurende 30 minuten voortgezet in 500 ml RBF, waarna de waterstofcyanide snel werd gedestilleerd onder verlaagde druk bij ongeveer 10 °C. Het residu werd gemengd met chloroform en ijswater en het resulterende mengsel werd gefiltreerd. De organische laag werd gescheiden en de waterige fase werd tweemaal geëxtraheerd met chloroform. De gecombineerde extracten werden gedroogd boven magnesiumsulfaat, ontkleurd en het oplosmiddel werd in vacuo gedestilleerd. Het product (12) werd gekristalliseerd uit ethylacetaat; opbrengst 3,3 g. (54% in totaal op basis van het alcoholhydrochloride), m.p. 172-174 °C. Herkristallisatie uit hetzelfde oplosmiddel verhoogde de m.p. tot 181-182 °C.
40 g droog, poedervormig natriumcyanide werd toegevoegd aan 300 ml ijskoud vloeibaar waterstofcyanide. Het mengsel werd geroerd en in ijs afgekoeld, en 7,5 g ruw amorf 4-acetyl-9-chloor-7-methyl-4,5,5a,6,6a,7,8,9-octahydroindolo [4,3f/g]-chinolinehydrochloride (11) werd toegevoegd. Het roeren werd gedurende 30 minuten voortgezet in 500 ml RBF, waarna de waterstofcyanide snel werd gedestilleerd onder verlaagde druk bij ongeveer 10 °C. Het residu werd gemengd met chloroform en ijswater en het resulterende mengsel werd gefiltreerd. De organische laag werd gescheiden en de waterige fase werd tweemaal geëxtraheerd met chloroform. De gecombineerde extracten werden gedroogd boven magnesiumsulfaat, ontkleurd en het oplosmiddel werd in vacuo gedestilleerd. Het product (12) werd gekristalliseerd uit ethylacetaat; opbrengst 3,3 g. (54% in totaal op basis van het alcoholhydrochloride), m.p. 172-174 °C. Herkristallisatie uit hetzelfde oplosmiddel verhoogde de m.p. tot 181-182 °C.
9-Carbomethoxy-7-methyl-4,5,5a,6,6a,7,8,9-octahydroindolo-[4,3-fg]-quinoline (13)
Het product (12) hierboven, 1,0 g, werd gemengd met 15 mL methanol en 0,25 mL water. Het mengsel werd afgekoeld en 2 mL geconcentreerd zwavelzuur werd langzaam toegevoegd. De oplossing werd afgesloten in een glazen buis onder stikstof en verhit bij 100 °C gedurende 23 tot 24 uur in 100 mL RBF met refluxkoeler. Het mengsel werd behandeld met ontkleurde koolstof en vervolgens geconcentreerd in vacuo tot ongeveer 10 mL. Het werd uitgegoten op een mengsel van chloroform (30 mL), ijs en 10 g natriumbicarbonaat. De chloroformlaag werd gescheiden en de waterige fase werd geëxtraheerd met 3 x 10 mL porties chloroform. De gecombineerde extracten werden gedroogd boven magnesiumsulfaat, ingedampt tot droogte, en het product (13) werd gekristalliseerd uit benzeen; opbrengst 0,51 g (53%), MP: 159-160 °C. Het werd opnieuw gekristalliseerd uit ethylacetaat; MP: 160-161 °C.
Het product (12) hierboven, 1,0 g, werd gemengd met 15 mL methanol en 0,25 mL water. Het mengsel werd afgekoeld en 2 mL geconcentreerd zwavelzuur werd langzaam toegevoegd. De oplossing werd afgesloten in een glazen buis onder stikstof en verhit bij 100 °C gedurende 23 tot 24 uur in 100 mL RBF met refluxkoeler. Het mengsel werd behandeld met ontkleurde koolstof en vervolgens geconcentreerd in vacuo tot ongeveer 10 mL. Het werd uitgegoten op een mengsel van chloroform (30 mL), ijs en 10 g natriumbicarbonaat. De chloroformlaag werd gescheiden en de waterige fase werd geëxtraheerd met 3 x 10 mL porties chloroform. De gecombineerde extracten werden gedroogd boven magnesiumsulfaat, ingedampt tot droogte, en het product (13) werd gekristalliseerd uit benzeen; opbrengst 0,51 g (53%), MP: 159-160 °C. Het werd opnieuw gekristalliseerd uit ethylacetaat; MP: 160-161 °C.
Synthetisch dl-Lyserginezuur (14)
Een mengsel van 9-carbomethoxy-7-methyl-4,5,5a,6,6a,7,8,9-octahydroindolo-[4,3-fg]-quinoline (13), 3,9 g, en 78 mL van 1,5% kaliumhydroxideoplossing werd 30 minuten refluxed onder stikstof. Gehydrateerd natriumarsenaat, 8,5 g, en Raney nikkel (16 g, nat), eerder gedeactiveerd door koken in xyleen suspensie, werd toegevoegd, en het mengsel werd verwarmd onder reflux en geroerd in een stikstofatmosfeer gedurende 20 uur in 200 mL RBF met reflux condensor. De oplossing werd behandeld met koolstof en het ruwe lyserginezuur (14) werd neergeslagen door neutralisatie tot pH 5,6. Het werd gefiltreerd en gewassen met stikstof. Het werd gefiltreerd en gewassen met water; opbrengst 1,04 g, MP: 240-242 °C dec. Een tweede gewas, 0,16 g, MP: 233-235 °C dec. werd ook verkregen; totale opbrengst 30%. Het zuur kon worden gezuiverd door het op te lossen in verdund ammoniumhydroxide, te behandelen met ontkleurende koolstof en opnieuw te recipiteren met kooldioxide, MP: 242-243 °C dec; een mengsel met dl-lyserginezuur gemaakt van natuurlijk d-lyserginezuur was eveneens 242-243 °C dec. Het watervrije zuur werd verkregen door drogen in vacuo gedurende enkele uren bij 150 °C.
Een mengsel van 9-carbomethoxy-7-methyl-4,5,5a,6,6a,7,8,9-octahydroindolo-[4,3-fg]-quinoline (13), 3,9 g, en 78 mL van 1,5% kaliumhydroxideoplossing werd 30 minuten refluxed onder stikstof. Gehydrateerd natriumarsenaat, 8,5 g, en Raney nikkel (16 g, nat), eerder gedeactiveerd door koken in xyleen suspensie, werd toegevoegd, en het mengsel werd verwarmd onder reflux en geroerd in een stikstofatmosfeer gedurende 20 uur in 200 mL RBF met reflux condensor. De oplossing werd behandeld met koolstof en het ruwe lyserginezuur (14) werd neergeslagen door neutralisatie tot pH 5,6. Het werd gefiltreerd en gewassen met stikstof. Het werd gefiltreerd en gewassen met water; opbrengst 1,04 g, MP: 240-242 °C dec. Een tweede gewas, 0,16 g, MP: 233-235 °C dec. werd ook verkregen; totale opbrengst 30%. Het zuur kon worden gezuiverd door het op te lossen in verdund ammoniumhydroxide, te behandelen met ontkleurende koolstof en opnieuw te recipiteren met kooldioxide, MP: 242-243 °C dec; een mengsel met dl-lyserginezuur gemaakt van natuurlijk d-lyserginezuur was eveneens 242-243 °C dec. Het watervrije zuur werd verkregen door drogen in vacuo gedurende enkele uren bij 150 °C.
Attachments
Last edited: