G.Patton
Expert
- Joined
- Jul 5, 2021
- Messages
- 2,704
- Solutions
- 3
- Reaction score
- 2,857
- Points
- 113
- Deals
- 1
Ievads
Kā gramus pārvērst mililitros un otrādi?
Kas ir moli?
Kas ir molmasa?
Kā pārvērst molus gramos un otrādi?
Cits piemērs: reakcijai jāpievieno 10 moli nātrija borohidrīda (NaBH4) ar molekulmasu 37,83 g/mol, un tas ir jāskaita uz gramiem:
Kā saskaitīt reaģentus?
Kā aprēķināt reakcijas iznākumu?
Tad saskaitiet, cik moli trūkstošā reaģenta (šajā piemērā P2P) piedalās reakcijā.
Es saņemu daudz vienādu jautājumu par reakciju iznākumiem, reaģentu daudzumu, kā vienu dimensiju pārvērst citā, un ievēroju, ka cilvēki nezina, kā pareizi saskaitīt šos vienkāršos, bet ļoti svarīgos skaitļus. Es nolēmu šajā tēmā aprakstīt pareizās metodes. Ja kaut ko nesaprotat, nekautrējieties jautāt un apspriest savus jautājumus komentāru sadaļā.
Kā gramus pārvērst mililitros un otrādi?
Grams (SI vienības simbols g) ir Starptautiskās mērvienību sistēmas(SI) masas vienība, kas vienāda ar vienu tūkstošdaļu no kilograma (1/1000). Grams ir tīra ūdens tilpuma absolūtā masa, kas vienāda ar metra simtās daļas kubu [1 cm3], un pie ledus kušanas temperatūras definējošā temperatūra (~0 °C) vēlāk tika mainīta uz 4 °C, kas ir ūdens maksimālā blīvuma temperatūra.
Pārrēķina koeficienti.
Pārrēķina koeficienti.
- 1 grams (g) = 15,4323583529 graudu (gr).
- 1 grauds (gr) = 0,06479891 grama.
- 1 avirdupuā unce (oz) = 28,349523125 grama.
- 1 Trojas unce (ozt) = 31,1034768 grama.
- 100 grami (g) = 3,527396195 unces (oz).
- 1 karāts (ct) = 0,2 grami.
- 1 gamma (γ) = 10-6 grami.
- 1 nedecimograms = 1 "vienpadsmitgrams" = 10-11 gramu vēsturiskajā kvadranta-vienpadsmitgrama-sekundes sistēmā (QES sistēmā) jeb hedometra-undecimogramma-sekundes sistēmā (HUS sistēmā).
- 500 grami (g) = 1 džins ķīniešu mērvienībās.
litrs (starptautiskā rakstība) vai litrs (amerikāņu angļu rakstība), SI simboli L un l. Litrs ir metriskā tilpuma mērvienība. Tā ir vienāda ar 1 kubikdecimetru (dm3), 1000 kubikcentimetriem (cm3) vai 0,001 kubikmetru (m3). Kubiskais decimetrs (vai litrs) aizņem tilpumu 10 cm × 10 cm × 10 cm (sk. attēlu) un tādējādi ir vienāds ar vienu kubikmetra tūkstošdaļu. Millilitrs, SI simbols ml vai ml ir kubikcentimetrs. Kubikcentimetrs (vai ml) aizņem tilpumu 1 cm × 1 cm × 1 cm un tādējādi ir vienāds ar vienu tūkstošdaļu litra (1/1000).
Pārrēķina koeficienti
 .
.
Pārrēķina koeficienti
- 1 imperiālais kvarts = 1,1365225 L.
- 1 ASV kvarts = 0,946352946 L.
- 1 imperiālā pinta = 0,56826125 L.
- 1 ASV pinta = 0,473176473 L.
- 1 imperiālais galons = 4,54609 L.
- 1 ASV galons = 3,785411784 L.
- 1 kubiskā pēda = 28,316846592 L.
- 1 kubikcolla = 0,016387064 L.
- 1 impērijas šķidruma unce = 28,4130625 ml.
- 1 ASV šķidruma unce = 29,5735295625 ml.
Gramus var viegli pārvērst mililitros pēc šīs formulas.
V = m / ρ.
kur m - vielas masa, g; ρ - vielas blīvums, g/ml; V - vielas tilpums.
Saskaņā ar šo formulu jebkuru vielu var pārvērst tilpumā un otrādi. Piemēram,jums ir 20 g dzīvsudraba (Hg), un jūs vēlaties aprēķināt tā masu. Dzīvsudraba ρ (blīvums) ir 13,5 g/ml, tātad
Saskaņā ar šo formulu jebkuru vielu var pārvērst tilpumā un otrādi. Piemēram,jums ir 20 g dzīvsudraba (Hg), un jūs vēlaties aprēķināt tā masu. Dzīvsudraba ρ (blīvums) ir 13,5 g/ml, tātad
V(Hg) = 20 g / 13,5 g/ml = 1,48 ml
1,48 ml Ir 20 g dzīvsudraba tilpums.
Kas ir moli?
Mols, simbols mol, n, ir vielas daudzuma mērvienība Starptautiskajā mērvienību sistēmā (SI). Vielas daudzuma mērvienība ir mērvienība, ar ko nosaka, cik daudz konkrētās vielas elementārvienību ir objektā vai paraugā (jebkurā vielā). Mols ir definēts kā tāds, kas satur tieši 6,02214085774 × 10²³ daļiņu (atomu, molekulu, jonu, elektronu vai citu objektu). Piemēram, 10 moli ūdens (ķīmiskais savienojums H2O) un 10 moli dzīvsudraba (ķīmiskais elements Hg) satur vienādu vielas daudzumu, un dzīvsudrabs satur tieši vienu atomu uz katru ūdens molekulu, neskatoties uz to, ka abiem ir dažādi tilpumi un masas. Katrā ziņā tas ir diezgan daudz, vai ne? Tas ir iemesls, kāpēc ir ērtāk zināt, kā grami jāpārrēķina uz moliem, nevis grami uz atomu skaitu.
Kas ir molmasa?
Molārā masa ir vielas īpašība, vielas masas attiecība pret tās daudzumu. Skaitliski vienāda ar 1 vielas molu masu, tas ir, vielas masa satur daļiņu skaitu, kas vienāds ar Avogadro skaitli. Molārā masa, izteikta g/mol, skaitliski sakrīt ar molekulāro masu, kas izteikta r.a.m., un relatīvo atommasu. Tomēr starp molāro masu un molekulāro masu ir atšķirība, tās ir tikai skaitliski vienādas un atšķiras pēc dimensijas.
Piemēram, skābekļa kā elementa molārā masa M(O) = 16 g/mol, bet kā vienkāršas vielas, kas sastāv no molekulām, O2 = 32 g/mol.
Sarežģītu molekulu molārās masas var noteikt, saskaitot tās veidojošo elementu molārās masas. Piemēram,ūdens H2O molekulmasa ir.
Piemēram, skābekļa kā elementa molārā masa M(O) = 16 g/mol, bet kā vienkāršas vielas, kas sastāv no molekulām, O2 = 32 g/mol.
Sarežģītu molekulu molārās masas var noteikt, saskaitot tās veidojošo elementu molārās masas. Piemēram,ūdens H2O molekulmasa ir.
M(H2O) = 2 x M(H) + M(O) = 2 x 1 g/mol + 16 g/mol = 18 g/mol.
Kā pārvērst molus gramos un otrādi?
Lai pareizi aprēķinātu molus, n, vielas ar noteiktu masu, m, (gramos), jums ir jāievēro gramu formulas formulas uz moliem.
n = m / M.
kur: M - šīs vielas molārā masa. Vienība parasti ir g/mol; m - vielas masa, g; n - vielas moli, mol.
Piemēram, jums ir 100 g P2NP, kura molekulmasa ir 163,17 g/mol. Jums ir jānoskaidro, cik moli tas ir. Saskaņā ar iepriekš minēto formulu.
Piemēram, jums ir 100 g P2NP, kura molekulmasa ir 163,17 g/mol. Jums ir jānoskaidro, cik moli tas ir. Saskaņā ar iepriekš minēto formulu.
n(P2NP) = 100 g / 163,17 g/mol = 0,6129 mola.
Cits piemērs: reakcijai jāpievieno 10 moli nātrija borohidrīda (NaBH4) ar molekulmasu 37,83 g/mol, un tas ir jāskaita uz gramiem:
m(NaBH4) = 10 moli x 37,83 g/mol = 378,3 g.
Kā saskaitīt reaģentus?
Jūs esat atvēris sintēzes rokasgrāmatu un esat sapratis, ka sintēzei nepieciešams daudz mazāks vai lielāks apjoms. Jūs mulsina skaitļi un nezināt, kā tos saskaitīt pēc skalas? Ir izskaidrojums.
Ja vēlaties palielināt sintēzes skalu un esat pārliecināts, ka to iespējams izdarīt saskaņā ar lineāro atkarību, jums vienkārši jāreizina visi reaģentu daudzumi ar vienādu indeksu. Iegūsiet savai sintēzes skalai atbilstošu reaģentu daudzumu, un jums par to nav jājautā nevienam ekspertam!
Piemērs : jūs vēlaties veikt amfetamīna sintēzi, izmantojot NaBH4/CuCl2, un saskaņā ar BB foruma rokasgrāmatu šai sintēzei ir nepieciešams ņemt 1000 g P2NP. Jūs vēlaties veikt 150 g P2NP sintēzes slodzes. Jūsu algoritms ir šāds.
Ja vēlaties palielināt sintēzes skalu un esat pārliecināts, ka to iespējams izdarīt saskaņā ar lineāro atkarību, jums vienkārši jāreizina visi reaģentu daudzumi ar vienādu indeksu. Iegūsiet savai sintēzes skalai atbilstošu reaģentu daudzumu, un jums par to nav jājautā nevienam ekspertam!
Piemērs : jūs vēlaties veikt amfetamīna sintēzi, izmantojot NaBH4/CuCl2, un saskaņā ar BB foruma rokasgrāmatu šai sintēzei ir nepieciešams ņemt 1000 g P2NP. Jūs vēlaties veikt 150 g P2NP sintēzes slodzes. Jūsu algoritms ir šāds.
1. Sadaliet rokasgrāmatā aprakstīto 1000 g galvenā prekursora P2NP daudzumu ar 150 g un iegūsiet vajadzīgo indeksu 6,67.
2. Sadaliet visu reaģentu daudzumus ar 6,67, un jūs sasniegsiet savu mērķi.
Janepieciešams palielināt šīs sintēzes slodzi no 1000 g P2NP līdz 2500 g, ievērojiet šos norādījumus.
1. 2500 g P2NP daliet ar 1000 g un iegūsiet indeksu 2,5.
2. Reaģentu skaitu reiziniet ar 2,5, un jūs sasniegsiet savu mērķi.
Kā aprēķināt reakcijas iznākumu?
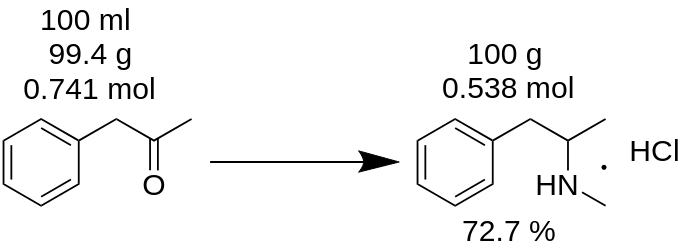
Jūs esat veicis metamfetamīna hidrohlorīda sintēzi no 100 ml P2P un ieguvis 100 g produkta. Jūs domājat, ka iegūtais iznākums ir 100 %? Tas ir nepareizi!
Piemērs.
Piemērs.
Vispirms jums ir jāsaskaita P2P masa, kas tika izmantota sintēzei.
m(P2P) = 100 ml / 1,006 = 99,4 g.
Tad saskaitiet, cik moli trūkstošā reaģenta (šajā piemērā P2P) piedalās reakcijā.
n(P2P) = 99,4 g / 134,178 g/mola = 0,741 mola.
Trūkuma reaģents ir reaģents, kas piedalās reakcijā, un tas ir reaģents ar vismazāko molu daudzumu. Piemēram, P2P reduktīvās aminācijas reakcijā ar metamfetamīnu jāņem 1 mols P2P un ~ 3,5 moli metilamīna. Šajā reakcijā P2P ir trūkstošais reaģents.
Saskaņā ar reakcijas bilanci no 1 molu P2P iegūst 1 molu metamfetamīna hidrohlorīda. Tādējādi 0,741 mola P2P dod 0,741 mola metamfetamīna hidrohlorīda (MH), kas ir
Saskaņā ar reakcijas bilanci no 1 molu P2P iegūst 1 molu metamfetamīna hidrohlorīda. Tādējādi 0,741 mola P2P dod 0,741 mola metamfetamīna hidrohlorīda (MH), kas ir
m(MH) = 0,741 mola x 185,69 g/mola = 137,56 g.
kur 185,69 g/mola ir metamfetamīna hidrohlorīda molekulmasa.
Teorētiskais iznākums. Teorētiskais iznākums ir vielas daudzums, kas jāiegūst kā reakcijas rezultāts. Tāpēc reakcijas iznākumu var aprēķināt no šī teorētiskā rezultāta.
Teorētiskais iznākums. Teorētiskais iznākums ir vielas daudzums, kas jāiegūst kā reakcijas rezultāts. Tāpēc reakcijas iznākumu var aprēķināt no šī teorētiskā rezultāta.
Iznākums, % = (m(teorija)*100)/m(prakse),
Iznākums (MH) = (100 g * 100) / 137,56 = 72,7 %.
Iznākums (MH) = (100 g * 100) / 137,56 = 72,7 %.
Kā redzams, reālais iznākums 72,7 % patiešām atšķiras no 100 % iznākuma, kas kļūdaini tika aprēķināts pēc reakcijas masas. Tas spēlē nozīmīgu lomu jebkuras vielas ražošanā.
Last edited:
