G.Patton
Expert
- Joined
- Jul 5, 2021
- Messages
- 2,704
- Solutions
- 3
- Reaction score
- 2,857
- Points
- 113
- Deals
- 1
Bevezetés
Hogyan lehet a grammot milliliterre váltani és fordítva?
Mi a mol?
Mi a moláris tömeg?
Hogyan lehet a mólokat grammra váltani és fordítva?
Egy másik példa: 10 mól 37,83 g/mol molekulatömegű nátrium-borohidridet (NaBH4) kell hozzáadni a reakcióhoz, és grammra kell számolni:
Hogyan kell a reagenseket megszámolni?
Hogyan számoljuk meg a reakcióhozamot?
Ezután számolja meg, hogy a hiányzó reagens (ebben a példában a P2P) hány molja vesz részt a reakcióban.
Sok ugyanolyan kérdést kapok a reakciók hozamával, a reagensek mennyiségével, az egyik dimenzió másik dimenzióba való átfordításával kapcsolatban, és észreveszem, hogy az emberek nem tudják, hogyan kell ezeket az egyszerű, de nagyon fontos számokat helyesen számolni. Úgy döntöttem, hogy ebben a témában ismertetem a helyes módszereket. Ha valamit nem értesz, ne habozz kérdezni és megvitatni a kérdéseket a megjegyzés rovatban.
Hogyan lehet a grammot milliliterre váltani és fordítva?
A gramm (SI-egységjelzéssel g) a Nemzetközi Egységrendszerben(SI) a kilogramm egy ezrelékének (1/1000) megfelelő tömegegység. Agramm egy tiszta víz térfogatának abszolút tömege, amely egyenlő a méter századrészének [1 cm3] kockájával, és az olvadó jég hőmérsékletén, a meghatározó hőmérséklet (~0 °C) később 4 °C-ra, a víz maximális sűrűségének hőmérsékletére változott.
Átváltási tényezők.
Átváltási tényezők.
- 1 gramm (g) = 15,4323583529 szem (gr).
- 1 szem (gr) = 0,06479891 gramm.
- 1 mázsás uncia (oz) = 28,349523125 gramm.
- 1 troy uncia (ozt) = 31,1034768 gramm.
- 100 gramm (g) = 3,527396195 uncia (oz).
- 1 karát (ct) = 0,2 gramm.
- 1 gamma (γ) = 10-6 gramm.
- 1 undecimogramme = 1 "tizenegyedik gramm" = 10-11 gramm a történelmi kvadráns-tizenegyedik gramm-másodperc rendszerben (QES-rendszer), más néven hebdometrus-undecimogramme-másodperc rendszerben (HUS-rendszer).
- 500 gramm (g) = 1 jin a kínai mértékegységekben.
A liter (nemzetközi helyesírás) vagy liter (amerikai angol helyesírás), SI-jelek L és l. A liter a térfogat metrikus mértékegysége. Megegyezik 1 köbdeciméterrel (dm3), 1000 köbcentiméterrel (cm3) vagy 0,001 köbméterrel (m3). Egy köbdeciméter (vagy liter) térfogata 10 cm × 10 cm × 10 cm (lásd az ábrát), tehát egy köbméter ezredrészének felel meg. A milliliter, SI-jelzéssel ml vagy mL köbcentiméter. Egy köbcentiméter (vagy ml) 1 cm × 1 cm × 1 cm térfogatot foglal el, és így egyenlő a liter egy ezrelékével (1/1000).
Átváltási tényezők
 Átváltási tényezők.
Átváltási tényezők.
Átváltási tényezők
- 1 birodalmi kvart = 1,1365225 liter.
- 1 U.S. quart = 0,946352946 L.
- 1 Imperial pint = 0,56826125 L.
- 1 U.S. pint = 0,473176473 L.
- 1 Imperial gallon = 4,54609 L.
- 1 U.S. gallon = 3,785411784 L.
- 1 köbláb = 28,316846592 L.
- 1 köbinch = 0,016387064 L.
- 1 birodalmi folyékony uncia = 28,4130625 ml.
- 1 amerikai folyékony uncia = 29,5735295625 mL.
Agrammokat könnyen át lehet alakítani milliliterre e képlet szerint.
V = m / ρ.
ahol m - az anyag tömege, g; ρ - az anyag sűrűsége, g/ml; V - az anyag térfogata.
Ezzel a képlettel minden anyagot át lehet alakítani térfogattá és fordítva. Például van 20 g higany (Hg), és ki akarod számítani a tömegét. ρ (sűrűsége) a higany 13,5 g/ml, tehát
Ezzel a képlettel minden anyagot át lehet alakítani térfogattá és fordítva. Például van 20 g higany (Hg), és ki akarod számítani a tömegét. ρ (sűrűsége) a higany 13,5 g/ml, tehát
V(Hg) = 20 g / 13,5 g/ml = 1,48 ml
1,48 ml 20 g higany térfogata.
Mi a mol?
A mol, jele mol, n, az anyagmennyiség mértékegysége a Nemzetközi Egységrendszerben (SI). Az anyagmennyiség annak a mértékegysége, hogy egy adott anyagból hány elemi egység van egy tárgyban vagy mintában (bármely anyagban). A mol meghatározása szerint pontosan 6,02214085774 × 10²³ részecskét (atomot, molekulát, iont, elektront vagy bármilyen más objektumot) tartalmaz. Például 10 mól víz (kémiai vegyület H2O) és 10 mól higany (kémiai elem Hg) azonos mennyiségű anyagot tartalmaz, és a higany a víz minden molekulájára pontosan egy atomot tartalmaz, annak ellenére, hogy a két anyag térfogata és tömege különböző. Mindenesetre ez elég sok, nem igaz? Ezaz oka annak, hogy kényelmesebb tudni, hogyan kell a grammot átváltani mólra, mint a grammot atomszámra.
Mi a moláris tömeg?
A moláris tömeg egy anyag jellemzője, az anyag tömegének és mennyiségének aránya. Számszerűen megegyezik az anyag 1 mol tömegével, vagyis az anyag tömege az Avogadro-számmal megegyező számú részecskét tartalmaz. A g/molban kifejezett moláris tömeg számszerűen egybeesik a r.a.m.-ben kifejezett molekulatömeggel és a relatív atomtömeggel. A moláris tömeg és a molekulatömeg között azonban különbség van, ezek csak számszerűen egyenlők, dimenziójukban különböznek.
Például az oxigén moláris tömege elemként M(O) = 16 g/mol, de molekulákból álló egyszerű anyagként O2 = 32 g/mol.
Az összetett molekulák moláris tömegei az őket alkotó elemek moláris tömegének összegzésével határozhatók meg. Például avíz H2O molekulatömege.
Például az oxigén moláris tömege elemként M(O) = 16 g/mol, de molekulákból álló egyszerű anyagként O2 = 32 g/mol.
Az összetett molekulák moláris tömegei az őket alkotó elemek moláris tömegének összegzésével határozhatók meg. Például avíz H2O molekulatömege.
M(H2O) = 2 x M(H) + M(O) = 2 x 1 g/mol + 16 g/mol = 18 g/mol.
Hogyan lehet a mólokat grammra váltani és fordítva?
Egy adott tömegű, m tömegű (grammban kifejezett) anyag mólszámának (n) helyes kiszámításához követni kell a gramm-mól képletet.
n = m / M.
ahol: M - az anyag moláris tömege. A mértékegység általában g/mol; m - az anyag tömege, g; n - az anyag moláris tömege, mol.
Például van 100 g P2NP, amelynek molekulatömege 163,17 g/mol. Meg kell határoznod, hogy ez hány mólos. Afenti képlet szerint.
Például van 100 g P2NP, amelynek molekulatömege 163,17 g/mol. Meg kell határoznod, hogy ez hány mólos. Afenti képlet szerint.
n(P2NP) = 100 g / 163,17 g/mol = 0,6129 mol.
Egy másik példa: 10 mól 37,83 g/mol molekulatömegű nátrium-borohidridet (NaBH4) kell hozzáadni a reakcióhoz, és grammra kell számolni:
m(NaBH4) = 10 mól x 37,83 g/mol = 378,3 g.
Hogyan kell a reagenseket megszámolni?
Kinyitotta a szintézis kézikönyvet, és rájött, hogy sokkal kevesebb vagy nagyobb léptékű szintézisre van szüksége. Összezavarodtál a számoktól, és nem tudod, hogyan számold őket a skáládra? Van rá magyarázat.
Ha növelni szeretné a szintézis léptékét, és biztos benne, hogy ez a lineáris függőség alapján lehetséges, akkor csak meg kell szoroznia az összes reagens mennyiségét ugyanazzal a mutatóval. Így megkapja a reagensek mennyiségét a szintézis skálájához, és nem kell erről szakértőt kérdeznie!
Példa: amfetamin szintézist szeretne végezni NaBH4/CuCl2 segítségével, és ehhez a szintézishez 1000 g P2NP-t kell vennie a BB fórumon található kézikönyv szerint. Ön 150 g P2NP szintézist szeretne elvégezni. Az algoritmusa a következő.
Ha növelni szeretné a szintézis léptékét, és biztos benne, hogy ez a lineáris függőség alapján lehetséges, akkor csak meg kell szoroznia az összes reagens mennyiségét ugyanazzal a mutatóval. Így megkapja a reagensek mennyiségét a szintézis skálájához, és nem kell erről szakértőt kérdeznie!
Példa: amfetamin szintézist szeretne végezni NaBH4/CuCl2 segítségével, és ehhez a szintézishez 1000 g P2NP-t kell vennie a BB fórumon található kézikönyv szerint. Ön 150 g P2NP szintézist szeretne elvégezni. Az algoritmusa a következő.
1. Ossza el a kézikönyvben leírt 1000 g P2NP fő prekurzor mennyiségét 150 g-mal, és megkapja a szükséges mutatót 6,67.
2. Ossza el az összes reagens mennyiségét 6,67-gyel, és eléri a célját.
Abban az esetben, haezt a szintézisterhelést 1000 g P2NP-ről 2500 g-ra kell felskáláznia, kövesse az alábbi utasításokat.
1. Ossza el a 2500 g P2NP-t 1000 g-mal, és megkapja a 2,5-es mutatót.
2. Szorozza meg az összes reagenseket 2,5-tel, és eléri a célját.
Hogyan számoljuk meg a reakcióhozamot?
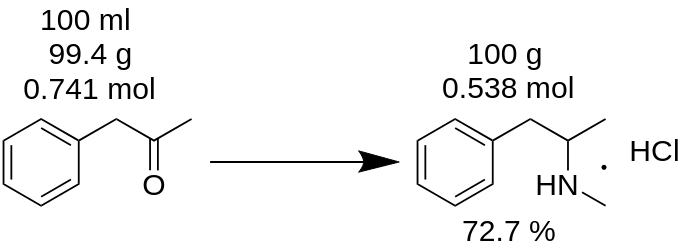
Ön 100 ml P2P-ből metamfetamin-hidroklorid szintézist hajtott végre, és 100 g terméket kapott. Úgy gondolod, hogy 100%-os hozamot értél el? Ez tévedés!
Példa.
Példa.
Először ismeg kell számolnia a szintézishez felhasznált P2P tömegét.
m(P2P) = 100 ml / 1,006 = 99,4g
Ezután számolja meg, hogy a hiányzó reagens (ebben a példában a P2P) hány molja vesz részt a reakcióban.
n(P2P) = 99,4 g / 134,178 g/mol = 0,741 mol.
A hiányzó reagens az a reagens, amelyik a reakcióban részt vesz, és amelynek a legkisebb a mólmennyisége. Például a P2P reduktív aminációjának metamfetaminná történő reakciójához 1 mól P2P-t és ~3,5 mól metilamint kell venni. A P2P ebben a reakcióban hiányzó reagens.
A reakciómérleg szerint 1 mól P2P 1 mól metamfetamin-hidrokloridot eredményez. Ezért 0,741 mol P2P 0,741 mol metamfetamin-hidrokloridot (MH)ad, ami
A reakciómérleg szerint 1 mól P2P 1 mól metamfetamin-hidrokloridot eredményez. Ezért 0,741 mol P2P 0,741 mol metamfetamin-hidrokloridot (MH)ad, ami
m(MH) = 0,741 mól x 185,69 g/mol = 137,56 g.
ahol 185,69 g/mol a metamfetamin-hidroklorid molekulatömege.
Elméleti hozamként ismert. Az elméleti hozam az az anyagmennyiség, amelyet a reakció eredményeképpen kapni kell. Ezért a reakcióhozamot ebből az elméleti eredményből számolhatja ki.
Elméleti hozamként ismert. Az elméleti hozam az az anyagmennyiség, amelyet a reakció eredményeképpen kapni kell. Ezért a reakcióhozamot ebből az elméleti eredményből számolhatja ki.
Kihozatal, % = (m(elmélet)*100)/m(gyakorlat),
Kihozatal (MH) = (100 g * 100) / 137,56 = 72,7 %.
Kihozatal (MH) = (100 g * 100) / 137,56 = 72,7 %.
Mint látható, a valós hozam 72,7 % valóban különbözik a 100 %-os hozamtól, amelyet tévesen a reakciótömegből számoltak ki. Ez jelentős szerepet játszik bármely anyag előállításában.
Last edited:
