G.Patton
Expert
- Joined
- Jul 5, 2021
- Messages
- 2,704
- Solutions
- 3
- Reaction score
- 2,857
- Points
- 113
- Deals
- 1
Εισαγωγή
Πώς να μετατρέψετε τα γραμμάρια σε χιλιοστόλιτρα και αντίστροφα;
Τι είναι τα μόρια;
Τι είναι η μοριακή μάζα;
Πώς μετατρέπονται τα mol σε γραμμάρια και αντίστροφα;
Ένα άλλο παράδειγμα, πρέπει να προσθέσετε 10 moles βοροϋδρίτη νατρίου (NaBH4) με μοριακή μάζα 37,83 g/moles στην αντίδραση και πρέπει να το μετρήσετε σε γραμμάρια:
Πώς μετράτε τα αντιδραστήρια;
Πώς να μετρήσετε την απόδοση μιας αντίδρασης;
Στη συνέχεια, μετρήστε πόσα mol ενός αντιδραστηρίου που λείπει (P2P σε αυτό το παράδειγμα) λαμβάνουν μέρος στην αντίδραση.
Λαμβάνω πολλές ίδιες ερωτήσεις σχετικά με τις αποδόσεις αντιδράσεων, την ποσότητα των αντιδραστηρίων, τον τρόπο μετατροπής μιας διάστασης σε άλλη και παρατηρώ ότι οι άνθρωποι δεν ξέρουν πώς να μετρήσουν σωστά αυτούς τους απλούς αλλά πολύ σημαντικούς αριθμούς. Αποφάσισα να περιγράψω τις σωστές μεθόδους σε αυτό το θέμα. Αν δεν καταλαβαίνετε κάτι, μη διστάσετε να ρωτήσετε και να συζητήσετε τις ερωτήσεις σας στην ενότητα των σχολίων.
Πώς να μετατρέψετε τα γραμμάρια σε χιλιοστόλιτρα και αντίστροφα;
Το γραμμάριο (σύμβολο μονάδας SI g) είναι μια μονάδα μάζας στο Διεθνές Σύστημα Μονάδων(SI) που ισούται με ένα χιλιοστό του χιλιόγραμμου (1/1000). Τογραμμάριο είναι το απόλυτο βάρος ενός όγκου καθαρού νερού ίσου με τον κύβο του εκατοστού μέρους του μέτρου [1 cm3] και στη θερμοκρασία τήξης του πάγου, η θερμοκρασία ορισμού (~0 °C) άλλαξε αργότερα σε 4 °C, τη θερμοκρασία μέγιστης πυκνότητας του νερού.
Συντελεστές μετατροπής
Συντελεστές μετατροπής
- 1 γραμμάριο (g) = 15,4323583529 κόκκοι (gr).
- 1 κόκκος (gr) = 0,06479891 γραμμάρια.
- 1 ουγγιά avoirdupois (oz) = 28,349523125 γραμμάρια.
- 1 ουγγιά troy (ozt) = 31,1034768 γραμμάρια.
- 100 γραμμάρια (g) = 3,527396195 ουγγιές (oz).
- 1 καράτι (ct) = 0,2 γραμμάρια.
- 1 γάμμα (γ) = 10-6 γραμμάρια.
- 1 undecimogramme = 1 "ενδέκατο γραμμάριο" = 10-11 γραμμάρια στο ιστορικό σύστημα quadrant-evenenth-gram-second (σύστημα QES) ή αλλιώς σύστημα hebdometre-undecimogramme-second (σύστημα HUS).
- 500 γραμμάρια (g) = 1 jin στις κινεζικές μονάδες μέτρησης.
Το λίτρο (διεθνής ορθογραφία) ή το λίτρο (αμερικανική αγγλική ορθογραφία), σύμβολα SI L και l. Το λίτρο είναι μετρική μονάδα όγκου. Ισούται με 1 κυβικό δεκάμετρο (dm3), 1000 κυβικά εκατοστά (cm3) ή 0,001 κυβικό μέτρο (m3). Ένα κυβικό δεκάμετρο (ή λίτρο) καταλαμβάνει όγκο 10 cm × 10 cm × 10 cm (βλ. σχήμα) και επομένως ισούται με το ένα χιλιοστό του κυβικού μέτρου. Το χιλιοστόλιτρο, σύμβολο SI ml ή mL είναι κυβικό εκατοστόμετρο. Ένα κυβικό εκατοστόμετρο (ή ml) καταλαμβάνει όγκο 1 cm × 1 cm × 1 cm και ισούται επομένως με ένα χιλιοστό του λίτρου (1/1000).
Συντελεστές μετατροπής

Συντελεστές μετατροπής
- 1 Imperial quart = 1,1365225 L.
- 1 αμερικανικό quart = 0,946352946 L.
- 1 Imperial pint = 0,56826125 L.
- 1 U.S. pint = 0,473176473 L.
- 1 Imperial gallon = 4,54609 L.
- 1 αμερικανικό γαλόνι = 3,785411784 L.
- 1 κυβικό πόδι = 28,316846592 L.
- 1 κυβική ίντσα = 0,016387064 L.
- 1 αυτοκρατορική υγρή ουγγιά = 28,4130625 mL.
- 1 αμερικανική υγρή ουγγιά = 29,5735295625 mL.
Ταγραμμάρια μπορούν εύκολα να μετατραπούν σε χιλιοστόλιτρα σύμφωνα με αυτόν τον τύπο.
V = m / ρ.
όπου m - μάζα της ουσίας, g- ρ - πυκνότητα της ουσίας, g/ml- V - όγκος της ουσίας.
Σύμφωνα με αυτόν τον τύπο, μπορείτε να μετατρέψετε κάθε ουσία σε όγκο και αντίστροφα. Για παράδειγμα, έχετε 20 g υδραργύρου (Hg) και θέλετε να υπολογίσετε τη μάζα του. ρ (πυκνότητα) του υδραργύρου είναι 13,5 g/ml, επομένως
Σύμφωνα με αυτόν τον τύπο, μπορείτε να μετατρέψετε κάθε ουσία σε όγκο και αντίστροφα. Για παράδειγμα, έχετε 20 g υδραργύρου (Hg) και θέλετε να υπολογίσετε τη μάζα του. ρ (πυκνότητα) του υδραργύρου είναι 13,5 g/ml, επομένως
V(Hg) = 20 g / 13,5 g/ml = 1,48 ml
1,48 ml είναι ο όγκος των 20 g υδραργύρου.
Τι είναι τα μόρια;
Το μόριο, σύμβολο mol, n, είναι η μονάδα της ποσότητας της ουσίας στο Διεθνές Σύστημα Μονάδων (SI). Η ποσότητα ποσότητας ουσίας είναι ένα μέτρο του πόσες στοιχειώδεις οντότητες μιας δεδομένης ουσίας υπάρχουν σε ένα αντικείμενο ή δείγμα (σε οποιαδήποτε ουσία). Το mole ορίζεται ότι περιέχει ακριβώς 6,02214085774 × 10²³ σωματίδια (άτομα, μόρια, ιόντα, ηλεκτρόνια ή οποιαδήποτε άλλα αντικείμενα). Για παράδειγμα, 10 μόρια νερού (μια χημική ένωση H2O) και 10 μόρια υδραργύρου (ένα χημικό στοιχείο Hg), περιέχουν ίσες ποσότητες ουσίας και ο υδράργυρος περιέχει ακριβώς ένα άτομο για κάθε μόριο του νερού, παρά το γεγονός ότι τα δύο έχουν διαφορετικούς όγκους και διαφορετικές μάζες. Εν πάση περιπτώσει, αυτό είναι αρκετά πολύ, έτσι δεν είναι; Αυτός είναι ο λόγος για τον οποίο είναι πιο βολικό να γνωρίζουμε πώς να μετατρέπουμε τα γραμμάρια σε μόρια αντί για τα γραμμάρια σε αριθμό ατόμων.
Τι είναι η μοριακή μάζα;
Η μοριακή μάζα είναι ένα χαρακτηριστικό μιας ουσίας, ο λόγος της μάζας μιας ουσίας προς την ποσότητά της. Αριθμητικά ισούται με τη μάζα 1 mole μιας ουσίας, δηλαδή η μάζα μιας ουσίας περιέχει αριθμό σωματιδίων ίσο με τον αριθμό Avogadro. Η μοριακή μάζα, εκφρασμένη σε g/mol, συμπίπτει αριθμητικά με τη μοριακή μάζα, εκφρασμένη σε r.a.m., και τη σχετική ατομική μάζα. Ωστόσο, υπάρχει διαφορά μεταξύ της μοριακής μάζας και της μοριακής μάζας, είναι μόνο αριθμητικά ίσες και διαφέρουν ως προς τη διάσταση.
Για παράδειγμα, η μοριακή μάζα του οξυγόνου ως στοιχείο M(O) = 16 g/mol, αλλά ως απλή ουσία που αποτελείται από μόρια O2 = 32 g/mol.
Οι μοριακές μάζες σύνθετων μορίων μπορούν να προσδιοριστούν με την άθροιση των μοριακών μαζών των στοιχείων που τα αποτελούν. Για παράδειγμα, η μοριακή μάζα του νερού H2O είναι.
Για παράδειγμα, η μοριακή μάζα του οξυγόνου ως στοιχείο M(O) = 16 g/mol, αλλά ως απλή ουσία που αποτελείται από μόρια O2 = 32 g/mol.
Οι μοριακές μάζες σύνθετων μορίων μπορούν να προσδιοριστούν με την άθροιση των μοριακών μαζών των στοιχείων που τα αποτελούν. Για παράδειγμα, η μοριακή μάζα του νερού H2O είναι.
M(H2O) = 2 x M(H) + M(O) = 2 x 1 g/mol + 16 g/mol = 18 g/mol.
Πώς μετατρέπονται τα mol σε γραμμάρια και αντίστροφα;
Για να εκτιμήσετε σωστά τον αριθμό των μορίων, n, μιας ουσίας συγκεκριμένης μάζας, m, (σε γραμμάρια), πρέπει να ακολουθήσετε τον τύπο μετατροπής από γραμμάρια σε μόρια.
n = m / M.
όπου: M - η μοριακή μάζα του υλικού αυτού. Η μονάδα είναι συνήθως g/mol- m - μάζα της ουσίας, g- n - mol της ουσίας, mol.
Για παράδειγμα, έχετε 100 g P2NP, το οποίο έχει μοριακή μάζα 163,17 g/mol. Πρέπει να υπολογίσετε πόσα mol είναι. Σύμφωνα με τον παραπάνω τύπο.
Για παράδειγμα, έχετε 100 g P2NP, το οποίο έχει μοριακή μάζα 163,17 g/mol. Πρέπει να υπολογίσετε πόσα mol είναι. Σύμφωνα με τον παραπάνω τύπο.
n(P2NP) = 100 g / 163,17 g/mol = 0,6129 mol.
Ένα άλλο παράδειγμα, πρέπει να προσθέσετε 10 moles βοροϋδρίτη νατρίου (NaBH4) με μοριακή μάζα 37,83 g/moles στην αντίδραση και πρέπει να το μετρήσετε σε γραμμάρια:
m(NaBH4) = 10 mol x 37,83 g/mol = 378,3 g.
Πώς μετράτε τα αντιδραστήρια;
Ανοίξατε το εγχειρίδιο σύνθεσης και συνειδητοποιήσατε ότι χρειάζεστε πολύ μικρότερη ή μεγαλύτερη κλίμακα σύνθεσης. Έχετε μπερδευτεί με τους αριθμούς και δεν ξέρετε πώς να τους μετρήσετε στην κλίμακα σας; Υπάρχει εξήγηση.
Σε περίπτωση που θέλετε να αυξήσετε την κλίμακα σύνθεσης και είστε σίγουροι ότι αυτό είναι δυνατόν να γίνει σύμφωνα με τη γραμμική εξάρτηση, πρέπει απλώς να πολλαπλασιάσετε όλες τις ποσότητες αντιδραστηρίων με τον ίδιο δείκτη. Θα πάρετε τις ποσότητες των αντιδραστηρίων για την κλίμακα σύνθεσής σας και δεν χρειάζεται να ρωτήσετε κάποιον Ειδικό για αυτό!
Παράδειγμα: θέλετε να πραγματοποιήσετε σύνθεση αμφεταμίνης μέσω NaBH4/CuCl2 και πρέπει να πάρετε 1000 g P2NP για αυτή τη σύνθεση σύμφωνα με το εγχειρίδιο από το φόρουμ BB. Θέλετε να πραγματοποιήσετε 150 g P2NP σύνθεση φορτίου. Οαλγόριθμός σας είναι ο εξής.
Σε περίπτωση που θέλετε να αυξήσετε την κλίμακα σύνθεσης και είστε σίγουροι ότι αυτό είναι δυνατόν να γίνει σύμφωνα με τη γραμμική εξάρτηση, πρέπει απλώς να πολλαπλασιάσετε όλες τις ποσότητες αντιδραστηρίων με τον ίδιο δείκτη. Θα πάρετε τις ποσότητες των αντιδραστηρίων για την κλίμακα σύνθεσής σας και δεν χρειάζεται να ρωτήσετε κάποιον Ειδικό για αυτό!
Παράδειγμα: θέλετε να πραγματοποιήσετε σύνθεση αμφεταμίνης μέσω NaBH4/CuCl2 και πρέπει να πάρετε 1000 g P2NP για αυτή τη σύνθεση σύμφωνα με το εγχειρίδιο από το φόρουμ BB. Θέλετε να πραγματοποιήσετε 150 g P2NP σύνθεση φορτίου. Οαλγόριθμός σας είναι ο εξής.
1. Διαιρέστε τα 1000 g της περιγραφόμενης στο εγχειρίδιο ποσότητας της κύριας πρόδρομης ουσίας P2NP με τα 150 g και θα λάβετε τον απαραίτητο δείκτη 6,67.
2. Διαιρέστε όλες τις ποσότητες αντιδραστηρίων με το 6,67 και θα φτάσετε στο στόχο σας.
Σε περίπτωση που πρέπει να αυξήσετε το φορτίο αυτής της σύνθεσης από 1000 g P2NP σε 2500 g, ακολουθήστε τις ακόλουθες οδηγίες.
1. Διαιρέστε τα 2500 g P2NP με τα 1000 g και θα έχετε τον δείκτη 2,5.
2. Πολλαπλασιάστε όλα τα αντιδραστήρια με το 2,5 και θα φτάσετε στο στόχο σας.
Πώς να μετρήσετε την απόδοση μιας αντίδρασης;
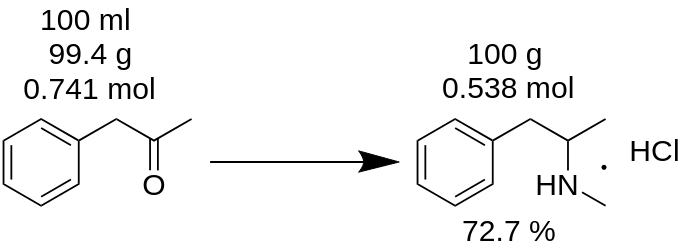
Πραγματοποιήσατε σύνθεση υδροχλωρικής μεθαμφεταμίνης από 100 ml P2P και πήρατε 100 g προϊόντος. Πιστεύετε ότι πήρατε 100% απόδοση; Είναι λάθος!
Παράδειγμα.
Παράδειγμα.
Πρώτα απ' όλα, πρέπει να μετρήσετε τη μάζα του P2P, το οποίο χρησιμοποιήθηκε για αυτή τη σύνθεση.
m(P2P) = 100 ml / 1,006 = 99,4g
Στη συνέχεια, μετρήστε πόσα mol ενός αντιδραστηρίου που λείπει (P2P σε αυτό το παράδειγμα) λαμβάνουν μέρος στην αντίδραση.
n(P2P) = 99,4 g / 134,178 g/μόριο = 0,741 mol.
Ένα αντιδραστήριο έλλειψης είναι το αντιδραστήριο, το οποίο συμμετέχει σε μια αντίδραση και αυτό με τη μικρότερη ποσότητα mol. Για παράδειγμα, στην αντίδραση αναγωγικής αμίνωσης P2P σε μεθαμφεταμίνη, πρέπει να πάρετε 1 mol P2P και ~3,5 mol μεθυλαμίνης. Το P2P είναι το αντιδραστήριο που λείπει σε αυτή την αντίδραση.
Σύμφωνα με το ισοζύγιο της αντίδρασης, 1 mol P2P δίνει 1 mol υδροχλωρικής μεθαμφεταμίνης. Επομένως, 0,741 mol P2P δίνουν 0,741 mol υδροχλωρικής μεθαμφεταμίνης (MH), η οποία είναι
Σύμφωνα με το ισοζύγιο της αντίδρασης, 1 mol P2P δίνει 1 mol υδροχλωρικής μεθαμφεταμίνης. Επομένως, 0,741 mol P2P δίνουν 0,741 mol υδροχλωρικής μεθαμφεταμίνης (MH), η οποία είναι
m(MH) = 0,741 moles x 185,69 g/mole = 137,56 g.
όπου 185,69 g/mole είναι η μοριακή μάζα της υδροχλωρικής μεθαμφεταμίνης.
Γνωστή ως θεωρητική απόδοση. Η θεωρητική απόδοση είναι η ποσότητα της ουσίας, η οποία πρέπει να ληφθεί ως αποτέλεσμα της αντίδρασης. Επομένως, μπορείτε να υπολογίσετε την απόδοση της αντίδρασης από αυτό το θεωρητικό αποτέλεσμα.
Γνωστή ως θεωρητική απόδοση. Η θεωρητική απόδοση είναι η ποσότητα της ουσίας, η οποία πρέπει να ληφθεί ως αποτέλεσμα της αντίδρασης. Επομένως, μπορείτε να υπολογίσετε την απόδοση της αντίδρασης από αυτό το θεωρητικό αποτέλεσμα.
Απόδοση, % = (m(θεωρία)*100)/m(πράξη),
Απόδοση (MH) = (100 g * 100) / 137,56 = 72,7 %.
Απόδοση (MH) = (100 g * 100) / 137,56 = 72,7 %.
Όπως μπορείτε να δείτε, η πραγματική απόδοση 72,7 % είναι πραγματικά διαφορετική από την απόδοση 100 %, η οποία υπολογίστηκε λανθασμένα από τη μάζα της αντίδρασης. Αποδίδει σημαντικό ρόλο στην παραγωγή οποιασδήποτε ουσίας.
Last edited:
